Используйте кинетику действующих масс, чтобы задать нулевой порядок, первый порядок, и обратимые реакции второго порядка.
Массовая акция описывает поведение реагентов и продуктов в элементарной химической реакции. Кинетика действующих масс описывает это поведение как уравнение, где скорость или уровень химической реакции прямо пропорциональны концентрации реагентов.
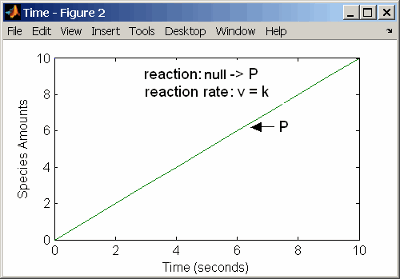
С реакцией нулевого порядка скорость реакции не зависит от концентрации реагентов. Примерами реакций нулевого порядка является синтез от null разновидности и моделирование исходной разновидности, которая добавляется к системе на заданном уровне.
reaction: null -> P
reaction rate: k mole/second
species: P = 0 mole
parameters: k = 1 mole/secondПримечание
При определении null разновидности, скорость реакции должна быть задана в модулях суммы в единицу времени не концентрация в единицу времени.
Ввод реакции выше в программное обеспечение и симуляцию приводит к следующему результату:
Кинетика действующих масс нулевого порядка
Примечание
Если сумма реагента с кинетикой нулевого порядка достигает нуля перед концом симуляции, то сумма реагента может понизиться нуль независимо от решателя или погрешностей, которые вы устанавливаете.
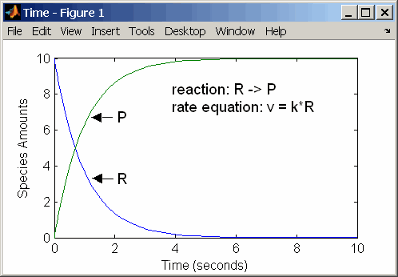
С реакцией первого порядка скорость реакции пропорциональна концентрации одного реагента. Примером реакции первого порядка является радиоактивное затухание.
reaction: R -> P
reaction rate: k*R mole/(liter*second)
species: R = 10 mole/liter
P = 0 mole/liter
parameters: k = 1 1/second
Ввод реакции выше в программное обеспечение и симуляцию приводит к следующим результатам:
Кинетика действующих масс первого порядка
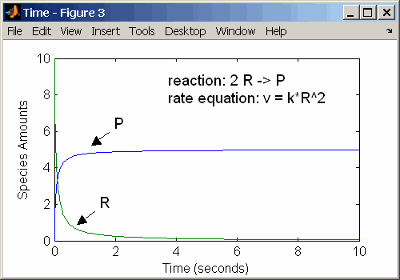
Реакция второго порядка имеет скорость реакции, которая пропорциональна квадрату или концентрации одного реагента или пропорциональна двум реагентам. Заметьте пробел между коэффициентом реагента и именем реагента. Без пробела, 2R был бы рассмотрен именем разновидности.
reaction: 2 R -> P
reaction rate: k*R^2 mole/(liter*second)
species: R = 10 mole/liter
P = 0 mole/liter
parameters: k = 1 liter/(mole*second)
Ввод реакции выше в программное обеспечение и симуляцию приводит к следующим результатам:
Кинетика второго порядка с одним реагентом
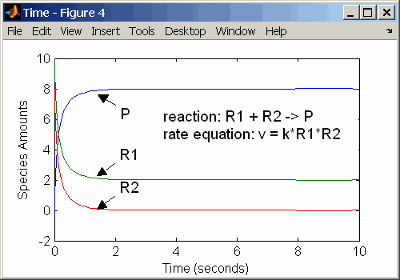
С двумя реагентами скорость реакции зависит от концентрации двух из реагентов.
reaction: R1 + R2 -> P
reaction rate: k*R1*R2 mole/(liter*second)
species: R1 = 10 mole/liter
R2 = 8 mole/liter
P = 0 mole/liter
parameters: k = 1 liter/(mole*second)
Введите реакцию выше в программное обеспечение, и симуляция приводит к следующим результатам. Существует различие в окончательных значениях, потому что начальная сумма одного из реагентов ниже, чем другой. После того, как первый реагент израсходован, остановки реакции.
Кинетика второго порядка с двумя реагентами
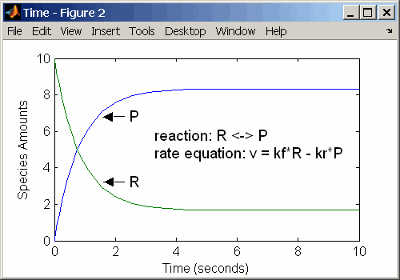
Можно смоделировать обратимые реакции с двумя отдельными реакциями или с одной реакцией. С одной обратимой реакцией скорости реакции для прямых и противоположных реакций объединены в одно выражение. Заметьте, что угловые скобки до и после дефиса представляют обратимую реакцию.
reaction: R <-> P
reaction rate: kf*R - kr*P mole/(liter*second)
species: R = 10 mole/liter
P = 0 mole/liter
parameters: kf = 1 1/second
kr = 0.2 1/second
Ввод реакции выше в программное обеспечение и симуляцию приводит к следующим результатам. В равновесии, когда уровень прямой реакции равняется противоположной реакции, v = kf*R - kr*P = 0 и P/R = kf/kr.