Используйте кинетику действующих масс, чтобы задать реакции нулевого порядка, первого порядка, второго порядка и обратимые реакции.
Массовое действие описывает поведение реагентов и продуктов в элементарной химической реакции. Кинетика действующих масс описывает это поведение как уравнение, где скорость или скорость химической реакции прямо пропорциональна концентрации реагентов.
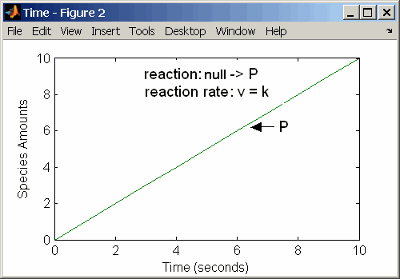
При реакции нулевого порядка скорость реакции не зависит от концентрации реагентов. Примерами реакций нулевого порядка являются синтез из null вид и моделирование исходного вида, который добавляется в систему с заданной скоростью.
reaction: null -> P
reaction rate: k mole/second
species: P = 0 mole
parameters: k = 1 mole/secondПримечание
При указании null вид, скорость реакции должна быть определена в единицах количества за модуль времени, а не в концентрации за модуль времени.
Ввод реакции выше в программное обеспечение и симуляция дает следующий результат:
Метод нулевого порядка Кинетики действующих масс
Примечание
Если количество реагента с кинетикой нулевого порядка достигает нуля до конца симуляции, то количество реагента может опуститься ниже нуля независимо от решателя или установленных вами допусков.
При реакции первого порядка скорость реакции пропорциональна концентрации единственного реагента. Примером реакции первого порядка является радиоактивный распад.
reaction: R -> P
reaction rate: k*R mole/(liter*second)
species: R = 10 mole/liter
P = 0 mole/liter
parameters: k = 1 1/second
Ввод реакции выше в программное обеспечение и симуляция дает следующие результаты:
Система первого порядка Кинетики действующих масс

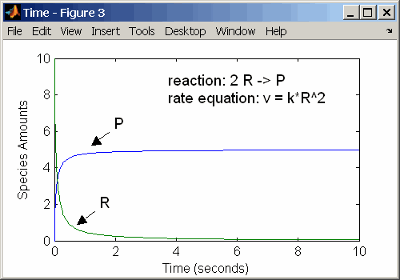
Реакция второго порядка имеет скорость реакции, которая пропорциональна квадрату или концентрации одного реагента или пропорциональна двум реагентам. Заметьте пространство между коэффициентом реагента и именем реагента. Без пространства, 2R будет считаться именем вида.
reaction: 2 R -> P
reaction rate: k*R^2 mole/(liter*second)
species: R = 10 mole/liter
P = 0 mole/liter
parameters: k = 1 liter/(mole*second)
Ввод реакции выше в программное обеспечение и симуляция дает следующие результаты:
Кинетика второго порядка с одним реагентом
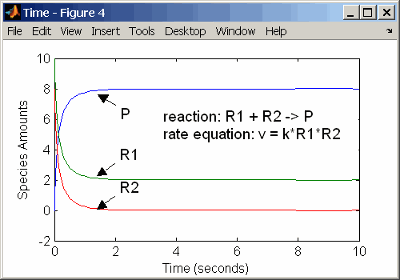
При использовании двух реагентов скорость реакции зависит от концентрации двух реагентов.
reaction: R1 + R2 -> P
reaction rate: k*R1*R2 mole/(liter*second)
species: R1 = 10 mole/liter
R2 = 8 mole/liter
P = 0 mole/liter
parameters: k = 1 liter/(mole*second)
Введите реакцию выше в программное обеспечение, и симуляция даст следующие результаты. Существует различие в конечных значениях, потому что начальное количество одного из реагентов ниже, чем другое. После того, как первый реагент используется, реакция прекращается.
Кинетика второго порядка с двумя реагентами
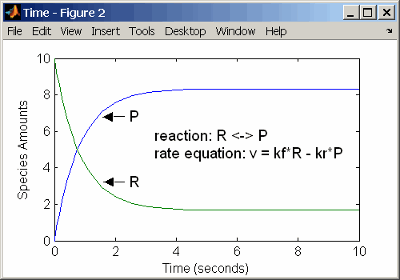
Можно смоделировать обратимые реакции с двумя отдельными реакциями или с одной реакцией. При одной обратимой реакции скорости реакции для прямой и обратной реакций объединяют в одно выражение. Заметьте угловые скобки до и после дефиса, чтобы представлять обратимую реакцию.
reaction: R <-> P
reaction rate: kf*R - kr*P mole/(liter*second)
species: R = 10 mole/liter
P = 0 mole/liter
parameters: kf = 1 1/second
kr = 0.2 1/second
Ввод реакции выше в программное обеспечение и симуляция дает следующие результаты. При равновесии, когда скорость прямой реакции равна обратной реакции, v = kf*R - kr*P = 0 и P/R = kf/kr.