Используйте дифференциальные уравнения, кинетику массового действия или кинетику Михаэлиса-Ментена для определения реакций фермента.
Простая модель катализируемых ферментом реакций запускает субстрат S обратимо связываясь с ферментом E. Часть субстрата в комплексе субстрат/фермент превращается в продукт. P с высвобождением фермента.
Эта простая модель может быть определена с помощью
Дифференциальные уравнения скорости. См. Ферментные реакции с дифференциальными уравнениями скорости.
Реакции с кинетикой массового действия. См. раздел Ферментные реакции с кинетикой массового действия.
Реакции с кинетикой Анри-Михаэлиса-Ментена. См. Ферментные реакции с необратимой кинетикой Анри-Михаэлиса-Ментена.
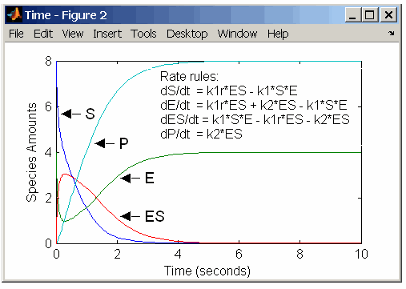
Реакции для механизма реакции фермента с одним субстратом (см. Простую модель катализируемых реакций с одним субстратом) можно описать уравнениями дифференциальной скорости. Можно ввести уравнения дифференциальной скорости в программу в качестве правил скорости.
reactions: none
reaction rate: none
rate rules: dS/dt = k1r*ES - k1*S*E
dE/dt = k1r*ES + k2*ES - k1*S*E
dES/dt = k1*S*E - k1r*ES - k2*ES
dP/dt = k2*ES
species: S = 8 mole
E = 4 mole
ES = 0 mole
P = 0 mole
parameters: k1 = 2 1/(mole*second)
k1r = 1 1/second
k2 = 1.5 1/secondПомните, что правило тарифа dS/dt = f(x) записывается в выражение правила скорости SimBiology ® какS = f(x). Дополнительные сведения о правилах тарифов см. в разделе Правила тарифов.
Кроме того, можно удалить правило ставки для ES, добавить новый вид Etotal для общего количества фермента и добавить алгебраическое правило 0 = Etotal - E - ES, где начальные суммы для Etotal и E равны.
reactions: none
reaction rate: none
rate rules: dS/dt = k1r*ES - k1*S*E
dE/dt = k1r*ES + k2*ES - k1*S*E
dP/dt = k2*ES
algebraic rule: 0 = Etotal - E - ES
species: S = 8 mole
E = 4 mole
ES = 0 mole
P = 0 mole
Etotal = 4 mole
parameters: k1 = 2 1/(mole*second)
k1r = 1 1/second
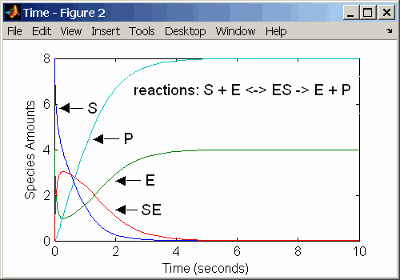
k2 = 1.5 1/secondОпределение дифференциальных уравнений скорости для реакций в модели занимает много времени. Лучший способ заключается в том, чтобы вводить реакции для механизма реакции одного субстратного фермента непосредственно в программное обеспечение. Следующий пример с использованием моделей катализируемой ферментом реакции с кинетикой массового действия. Описание модели реакции см. в разделе Простая модель катализируемых реакций с одним субстратом.
reaction: S + E -> ES
reaction rate: k1*S*E (binding)
reaction: ES -> S + E
reaction rate: k1r*ES (unbinding)
reaction: ES -> E + P
reaction rate: k2*ES (transformation)
species: S = 8 mole
E = 4 mole
ES = 0 mole
P = 0 mole
parameters: k1 = 2 1/(mole*second)
k1r = 1 1/second
k2 = 1.5 1/secondРезультаты моделирования с использованием реакций идентичны результатам использования дифференциальных уравнений скорости.
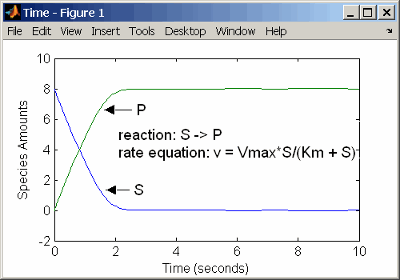
Представление катализируемой ферментом реакции с кинетикой массового действия требует знания констант скорости k1, k1r, и k2. Однако эти константы скорости редко сообщаются в литературе. Чаще дают константы скорости для кинетики Анри-Михаэлиса-Ментена с максимальной скоростью Vm=k2*E и константа Km = (k1r + k2)/k1. Скорость реакции одного субстратного фермента с использованием кинетики Анри-Михаэлиса-Ментена приведена ниже. Сведения о модели см. в разделе Простая модель катализируемых реакций с одной подложкой.
S]
В следующем примере моделируется катализируемая ферментом реакция с использованием кинетики Анри-Михаэлиса-Ментена с одной реакцией и уравнением скорости реакции. Введите в программу реакцию, определенную ниже, и смоделируйте.
reaction: S -> P
reaction rate: Vmax*S/(Km + S)
species: S = 8 mole
P = 0 mole
parameters: Vmax = 6 mole/second
Km = 1.25 moleРезультаты показывают, что график немного отличается от графика с использованием кинетики массовых действий. Различия обусловлены допущениями, сделанными при выводе уравнения скорости Михаэлиса-Ментена.